Раковые клетки уличили в обмене резистентностью
Специалисты из Калифорнийского университета в Сан-Диего обнаружили механизм, позволяющий раковым клеткам обмениваться резистентностью к препаратам.
Гликолиз раковых клеток происходит в анаэробных условиях. В норме нехватка питательных веществ провоцирует в тканях стрессовые реакции, способные привести к апоптозу. В случае опухолей речь нередко идет об эндоплазматическом стрессе — он возникает вследствие накопления неправильно свернутых или поврежденных белков в эндоплазматическом ретикулуме. Чтобы восстановить дефектные молекулы и ограничить их синтез, в раковых клетках запускается отклик неструктурированных белков (unfolded protein response, UPR). Причем выработка шаперонов инициирует аналогичный механизм в соседних клетках. (Шаперо́ны (англ. chaperones) — класс белков, главная функция которых состоит в восстановлении правильной нативной третичной или четвертичной структуры белков, а также образование и диссоциация белковых комплексов).
Прошлые работы показали, что такие реакции позволяют опухолям локально модулировать работу иммунной системы, подавляя активность наивных CD8 Т-лимфоцитов. В новой работе американские исследователи изучили этот механизм. На первом этапе они моделировали эндоплазматический стресс в культуре клеток человеческого рака простаты, после чего их питательную среду смешивали с другими раковыми и здоровыми образцами. Согласно гипотезе, сигнальные молекулы оригинального биоматериала должны стимулировать экспрессию маркеров антистрессового ответа в контрольных клетках. Предположение подтвердилось: последние адаптировались к анаэробному гликолизу, а риск их апоптоза снизился.
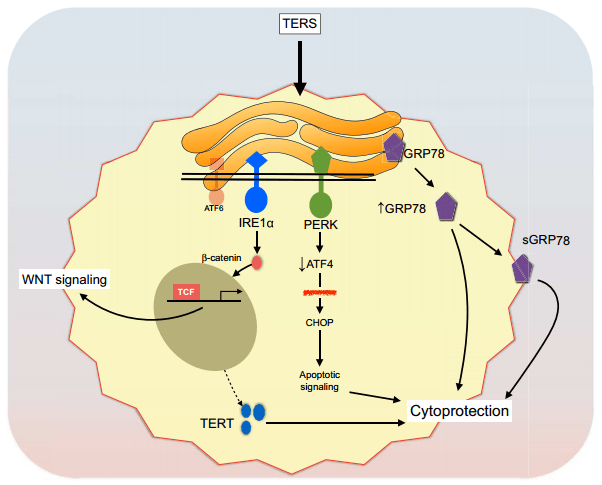
Примечательно, что помимо увеличения выживаемости искусственный эндоплазматический стресс повысил устойчивость экспериментальных образцов к лекарственным препаратам, в том числе тем, действие которых не основано на деградации белков, например паклитакселу. Затем, чтобы проверить тенденцию in vivo и проследить за развитием опухоли, исследователи привили полученные клетки мышам. Наблюдения подтвердили, что подобное стрессирование ускоряет рост новообразований (опухоль возникала на восьмой день против 14-го). Спустя месяц опухоли подопытных животных (получивших клетки с индуцированной устойчивостью) оказались больше, чем у особей из контрольной группы.
При этом гистологический анализ и иммунохимическое окрашивание образцов не выявило значительных морфологических различий. По словам ученых, это свидетельствует о том, что опухоли с искусственным эндоплазматическим стрессом не имели преимущества пролиферации перед контрольными и их ускоренный рост, вероятно, связан только с обработкой. Определение молекулярного механизма развития резистентности к препаратам может помочь в разработке более эффективных терапевтических стратегий. Ранее схожий отклик, защищающий от голодания, был обнаружен у нематод Caenorhabditis elegans, что также указывает на эволюционную консервативность таких реакций.
Подробности работы представлены в журнале Science Signaling.
Ранее шведские исследователи пришли к выводу, что «иммунитет» раковых клеток к оксидативному стрессу может обеспечиваться за счет онкогенного белка MTH1. Подавление его экспрессии привело к гибели опухолей.
источник
